Ayant en 1979 besoin de synthétiser pour mes travaux personnels de thèse un alcène particulier, accessible certes par réaction de Wittig en milieu homogène anhydre ou en transfert de phase liquide liquide, je substituais par commodité le milieu eau/benzène par du dioxanne-1,4, la soude restant sous forme solide. Le résultat fut stupéfiant puisque l’alcène fut obtenu sélectivement avec un rendement quantitatif. Les traces d’eau présentes à l’interface solide/liquide, en modifiant la nature des interactions entre anions et cations de la base solide, étaient en fait à l’origine de ce résultat. Une des premières réactions de transfert de phase solide/liquide en milieu organique faiblement hydraté venait de voir le jour.
Alcènes fonctionnalisés et époxydes fonctionnalisés
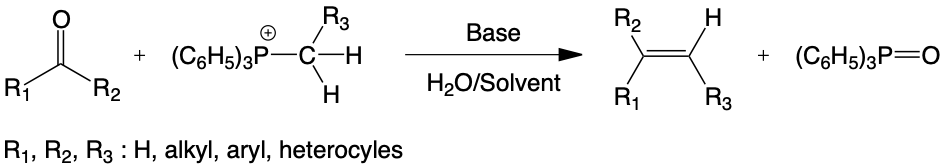
Le furfural choisi comme molécule modèle a ainsi été transformé quantitativement en 2-vinyl furane ou en alcènes fonctionnalisés correspondants en présence d’un hydroxyde ou d’un carbonate alcalin solide, d’une phase organique constituée par le solvant, des réactifs considérés et de traces d’eau en quantités soigneusement quantifiées. Cette réaction, généralisée à l’ensemble de la fonction carbonyle, procède selon un mécanisme réactionnel original qui privilégie, grâce à la solvatation spécifique des espèces intermédiaires à l’interface solide/liquide, une orientation préférentielle vers l’alcène Z ou E.
Elle permet également la transformation des aldéhydes phénoliques en alcènes correspondants et notamment la première synthèse directe à partir du p-hydroxy-benzaldéhyde du 2-vinyl phénol ou p-hydroxystyrène, monomère de grand intérêt en chimie macromoléculaire.
De plus, la modulation possible des interactions acido-basiques permet pour la première fois d’obtenir, en favorisant la formation de l’ylure au détriment de la réaction d’aldolisation, la transformation d’aldéhydes aliphatiques en alcènes correspondants avec de hauts rendements.
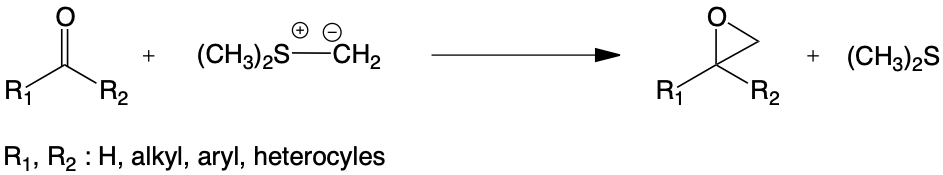
La transformation d’un dérivé carbonylé en époxydes en utilisant un milieu hétérogène solide-liquide faiblement hydraté a été mise au point avec le furfural puis généralisée à divers aldéhydes et cétones : aromatiques, hétéroaromatiques et aliphatiques.
Cette étude a mis en évidence les bonnes performances des sels de sulfonium alkylés bromés et de l’hydroxyde de potassium en poudre comme base. L’utilisation de sel de thiolanium a permis pour la première fois l’obtention stéréosélective d’époxyesters.
La nécessité d’utiliser une base solide, dans certains cas différente de l’hydroxyde de potassium, a bien fait ressortir l’importance des interactions acido-basiques et moléculaires entre le sel de sulfonium et l’agent basique.
L’analyse Infra-Rouge et une étude cristallographique montrent que la formation de l’ylure de sulfonium et donc celle de l’époxyde exige :
- un pouvoir basique de la base suffisant pour arracher le proton du sel de sulfonium,
- une structure de la maille cristalline de l’agent basique compatible avec celle du sel de sulfonium afin qu’elle puisse permettre l’approche du sel vers ses sites actifs et assurer à l’ylure une stabilité ainsi qu’un pouvoir nucléophile suffisant pour attaquer la fonction carbonyle.
Par ailleurs, il apparaît que les molécules d’eau introduites au début de la réaction en quantité contrôlée et localisées à la surface de la base jouent un rôle déterminant au niveau :
- de la formation de l’ylure de sulfonium en modifiant la surface du réseau cristallin,
- du réarrangement de la bétaïne en diminuant les interactions de l’oxyanion avec la base.
Enfin, une étude de la cinétique de la réaction d’époxydation du furfural et des conditions de traitement du milieu réactionnel nous a permis, grâce à une extraction liquide-liquide, d’isoler 95 % de 2-furyl oxiranne avec une pureté de 96 %.
Esters éthyléniques fonctionnalisés et formylation des aldéhydes phénoliques
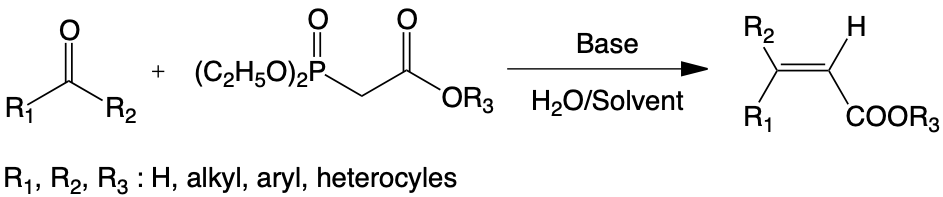
La condensation de diéthylphosphonoacétate d’alkyle avec le furfural, l’hydroxyméthylfurfural, et un très grand nombre de cétones et d’aldéhydes en milieu hétérogène solide/ liquide faiblement hydraté, conduit sélectivement et quantitativement aux esters éthyléniques correspondants. Une réaction de transestérification successive en milieu protique permet d’accéder selon la nature de l’alcool utilisé à une nouvelle classe d’esters.
La caractérisation spectroscopique des espèces intermédiaires localisées à l’interface solide-liquide montre que ces réactions se déroulent selon un mécanisme réactionnel caractérisé par :
- une influence déterminante des structures carbanioniques intermédiaires,
- la nécessité d’une compatibilité entre la structure microcristalline de la base et le phosphonate considéré,
- l’existence d’un processus interfacial monoadsorbé avec le composé carbonylé en solution,
- le rôle de l’eau qui permet à la base solide de présenter une structure microcristalline compatible avec les substrats en présence et qui favorise la décomposition finale de l’oxaphosphétane intermédiaire,
- la régénération des centres actifs de la base solide assistée par le phosphate généré en fin de réaction sous forme d’acide.
L’utilisation de soude solide en présence de traces d’eau soigneusement quantifiées permet la formylation du phénol par le chloroforme et donc la synthèse avec des rendements élevés du parahydroxybenzaldéhyde et du salicylaldéhyde.

La formylation est régie par la génération puis par la réactivité relative à l’interface solide-liquide du dichlorocarbène et du phénate. La formation des dialdéhydes procède essentiellement par double formylation simultanée du phénol grâce à la stabilisation d’un intermédiaire chlorocarboné par l’alcool à l’interface solide-liquide. Le procédé de synthèse généralisé à différents phénols substitués conduit à de remarquables résultats. Ainsi le guaïcol est transformé pour la première fois quantitativement en vanilline, orthovanilline et 2,4-diformyl 6-methoxy phénol.
Thiiranes et nitriles insaturés
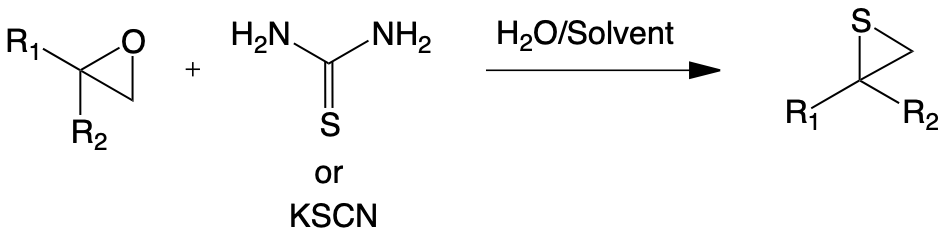
Une autre illustration de l’efficacité du milieu hétérogène solide-liquide faiblement hydraté dans les synthèses organiques est la transformation d’époxydes en thiiranes.
En effet, une nouvelle méthode d’obtention de ces dérivés soufrés a été proposée en mettant en jeu un agent soufré solide (thiourée ou thiocyanate de potassium) en présence d’une faible quantité d’eau.
Deux voies d’accès sont étudiées. Elles font appel aux performances exceptionnelles de l’activation anionique en milieu hétérogène faiblement hydraté. Les agents cyanés sont le diéthylphosphonacétonitrile et l’acétonitrile. Ils conduisent selon les aldéhydes ou les cétones considérés aux acrylonitriles substitués correspondants.
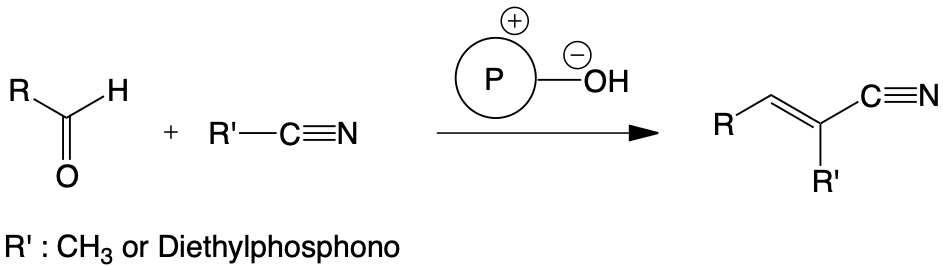
De remarquables résultats ont été obtenus avec les aldéhydes furaniques dont la réactivité restait mal maîtrisée jusqu’alors avec les techniques classiques.